Персонализированная медицина: как лечат то, что еще вчера было приговором
Каковы шансы Украины достичь «устойчивых» здоровья и благополучия для всех своих граждан

Вполне здорового пятинедельного малыша срочно госпитализировали в детскую больницу Рэди-Сан-Диего, Калифорния, после того, как он в течение двух часов заходился от плача, который, казалось, не имел видимых причин. Компьютерная томография головы показала крупные множественные отклонения плотности тканей.
Родители были в отчаянии. Десять лет назад у их первого ребенка спустя несколько месяцев после рождения начались подобные неврологические проявления, которые быстро прогрессировали до эпилептической энцефалопатии. Одиннадцатимесячный малыш умер без диагноза.
К счастью, 10 лет в науке – большой срок. Проблема, которая тогда казалась неразрешимой и стала причиной болезни в 2021 году, была решена менее, чем за сутки. Два часа ушло на необходимые процедуры, в том числе сбор анализов, 11 часов занял секвестр генома, и через 16,5 часа был поставлен диагноз – синдром дисфункции метаболизма тиамина 2 (THMD2).
Парадокс у том, что при такой сложной диагностике и возможных фатальных последствиях лечение этой болезни оказалось элементарным – витамины B1 и В7 (биотин). Уже через 6 часов после первого приема симптомы заболевания исчезли.
Основная проблема в том, что поставить такой диагноз без персонализированной генной медицины практически невозможно. Синдром THMD2 – крайне редкое генетическое заболевание, которое, по оценке ученых, встречается у одного младенца из миллиона. Большинство врачей если и знает о нем, то не в состоянии поставить диагноз на основе традиционного физикального обследования. И даже общий диагноз поможет мало: детская энцефалопатия – заболевание, поражающее или полностью уничтожающее клетки мозга, – связана примерно с 1500 генетическими заболеваниями, многие из которых клинически неотличимы и требуют уникального лечения.

ООН, Обама, Гиппократ и Цукерберг
Третья цель устойчивого развития ООН – «Обеспечение здорового образа жизни и содействие благополучию для людей в любом возрасте», от младенцев до стариков. Для достижения цели необходимы «дополнительные усилия для полной ликвидации широкого спектра болезней и решения многих различных постоянных и новых проблем здравоохранения».
Но до недавних пор множество заболеваний, таких как, например, синдром Альцгеймера, не поддавались эффективному лечению традиционными способами. Как и редкие генетические заболевания, о которых в XX веке только начали догадываться, а в XXI – пытаться лечить. Все они вкупе с раком, СПИДом, нейродегенеративными заболеваниями наносят огромный урон отдельным людям, семьям и обществу в целом, разрушая попытки человечества достичь устойчивого развития.
Так откуда же возьмутся эти самые дополнительные усилия, которых требует ООН? С недавних пор США и ЕС видят спасение в персонализированной медицине, которую еще называют точной или прецизионной (Precision Medicine Initiative). Это «новый подход к лечению и профилактике заболеваний, который учитывает индивидуальную изменчивость генов, окружающей среды и образа жизни каждого отдельно взятого человека».
Первым из глобальных политиков ее оценил Барак Обама. В своем обращении еще в январе 2015 года тогдашний президент США объявил, что запускает Инициативу точной (персонализированной) медицины. Обама назвал ее смелым исследовательским усилием, революцией в том, как мы улучшаем здоровье и лечим болезни.
В будущее такого подхода поверил и бизнес: Билл Гейтс вложил $50 млн в исследование болезни Альцгеймера на основе точных данных, а Цукерберг и его жена, доктор Присцилла Чан, пожертвовали $10 млн на развитие Университета Северной Каролины UCSF Spoke, который называют «мозгом» точной медицины.
Сегодня уже ВОЗ называет развитие системы здравоохранения, ориентированной на каждого конкретного индивида, одним из приоритетов своей европейской политики.
Впрочем, в самой идее мировых лидеров – ничего нового.
Еще Гиппократ подчеркивал важность лечения каждого пациента как отдельного человека. «Не все пациенты могут пить одно и то же (лекарство)», – писал он. А фраза о том, что «врач должен лечить больного, а не болезнь» стала крылатой еще в XІX веке.
Правда, Гиппократ, трудившийся в V веке до нашей эры, мог персонализировать методы лечения только исходя из явно наблюдаемых особенностей пациента. С развитием науки процесс вышел на новый уровень. Персонализированная медицина обещает индивидуальные методы лечения, основанные на изучении того, что действительно делает нас уникальными – нашей ДНК.
Если совсем коротко, то процедура выглядит так: человек сдает анализ ДНК, данные его генома расшифровываются, врач оценивает результаты, выдает рекомендации и выписывает лекарство, максимально подходящее конкретному человеку. При этом учитываются тонкие факторы и взаимодействия, которые практически невозможно оценить без изучения генома и побочных последствий частей самого препарата.
Главное преимущество технологии – возможности. Главный недостаток – стоимость.
Что может персонализированная медицина
Сегодня медики выделяют несколько основных направлений персонализированной медицины.
Первый, профилактический – преддиагностика потенциальных заболеваний на основе раскрытия генетической информации каждого человека, выявление «слабых мест» организма и предупреждение потенциальных рисков, которые могут проявиться в течение жизни под влиянием разнообразных внешних факторов. Речь идет не только о редких заболеваниях или раке, но и о сепсисе, сердечно-сосудистых заболеваниях и даже депрессии. Такой подход уже доступен в развитых странах и позволяет предупредить практически все заболевания, связанные с генетикой и воздействием на организм окружающей среды и образа жизни.
Второй – вычленение типичных (частых или редких) мутаций генов (биомаркеров) и создание методологий и препаратов для групп людей, в геноме которых эта мутация присутствует. В такой группе может быть от нескольких до сотен тысяч человек, что позволяет снизить стоимость лечения, оставляя его фактически индивидуальным.
Третий – полностью индивидуальное лечение. Этот подход, как правило, наиболее дорогостоящий, поскольку включает два сложнейших процесса: вмешательство на уровне генов для исправления «ошибок» в коде ДНК и составление персональных рецептов лекарств для конкретного пациента.
Как это выглядит на практике: генетическое направление
На данный момент самый большой сегмент применения персонализированной медицины – онкология. Она занимает 34,75% рынка. К 2021 году уже было выявлено более 100 видов злокачественных новообразований, при этом для каждой опухоли характерны различные биохимические и генетические особенности. Именно поэтому пока никому не удалось разработать универсальные эффективные методы лечения. По данным Bayer, «в области противоопухолевой терапии показатели частоты ответа на некоторые методы лечения достигают лишь 20%, или, другими словами, ответ на терапию отмечается только у каждого пятого пациента».
Это весомый аргумент в пользу разработки персонализированных подходов и необходимости создавать препараты, прицельно воздействующие на конкретные типы опухолей. Чем более точно лекарственное средство определяет спектр своего воздействия на злокачественные клетки, тем более выраженным будет его эффект в отношении конкретного заболевания и тем ниже будет риск развития побочных эффектов.
С другой стороны, ученые трудятся над разработкой специфических методов анализа, которые даже перед началом лечения позволят определить, окажет ли препарат выраженный терапевтический эффект на конкретную форму злокачественного новообразования, имеющегося у пациента.
В 2020 году в мире зафиксировано примерно 19,3 млн новых случаев онкозаболеваний и почти 10 млн случаев смерти от рака. Цифры точного количества пациентов, которые были спасены благодаря инновациям в медицине просто не существует. При этом FDA уже одобрило десятки лекарств, целенаправленно борющихся с конкретной мутацией раковых клеток. К таким, например, относятся иматиниб (Гливек) – лекарство, используемое при хроническом миелолейкозе, или лекарство от рака груди трастузумаб (Герцептин).

Как это выглядит на практике: выращивание органоидов
Негенетическое направление точной медицины, позволяющее получить точный тест воздействия даже непроверенного еще лекарства на организм человека, состоит в использовании «органоидов». Эту технологию также называют organ-on-a-chip и заключается она в искусственном выращивании клеток (и целых тканей) тела конкретного человека для проверки препаратов.
Первые органоиды состояли из живых клеток, встроенных в трехмерную матрицу гидрогеля и соединенных с потоком питательной жидкости каналами с размерами, измеряемыми в сотнях микрометров.
Современные устройства состоят из нескольких типов клеток и точно имитируют некоторые внутренние микроструктуры и функции органов. В результате человек, сдавший для такого эксперимента несколько клеток, может удаленно получить копию одного или нескольких своих органов, на которых и испытываются различные методы лечения. В итоге для пациента изготавливают препарат, который максимально подходит именно его организму.
Будущее уже наступило.
Если раньше эти системы создавались-выращивались вручную, то сегодня их уже печатают на 3D-принтерах и применяют в создании биомоделей для исследований в области онкологии. То есть фактически медики вплотную подошли к опытам на человеке – но без участия самого человека.
Используя трехмерную биопечать, фотолитографию и ряд других методов, исследовательские группы создали всевозможные органоиды, которые воспроизводят определенные функции своих аналогов в организме человека – кишечник, который поглощает питательные вещества, раковые образования, поражающие другие ткани, сердечную мышцу, которая сокращается, и даже легкое, «вдыхающее» сигаретный дым.

Но настоящая ценность технологии проявляется, когда вы соединяете органоиды вместе. Например, в Корнелльском университете (США) построили микрофизиологическую систему, которая содержит три типа органоидов: печень, костный мозг и опухоль толстой кишки – на одном чипе с закрытым кровообращением. Исследователи использовали его для изучения метаболизма лекарства, построенного на базе противоракового нетоксичного препарата Тегафур, который уже давно применяется в медицине. Если вводить лекарство перорально, его эффект ограничен, но если непосредственно в печень – он, как оказалось, метаболизируется ферментом и становится эффективным против рака. Поскольку препарат не новый, меняется только способ его применения, это может существенно снизить стоимость лечения и сделать его более доступным.
Цена вопроса: в мире и в Украине
Одна из самых больших претензий к персонализированной медицине – ее стоимость, что автоматически означает недоступность ее для большинства людей. А ведь в глобальной повестке ООН наравне с качественной медициной акцент делается и на ее доступности.
Практика показывает, что затраты со временем сокращаются, а эффективность растет по экспоненте. Первая расшифровка последовательности генома человека 30 лет назад стоила $3 млрд. В 2010-х компании уже предлагали индивидуальное секвенирование генома за несколько тысяч долларов, сегодня полная расшифровка в США стоит около тысячи долларов, а частичная – не больше $100.
При этом, если пациент в США соглашается предоставить некоторую информацию о своем здоровье, которая будет использована в дальнейшем научном анализе, секвенирование будет для него и вовсе бесплатным.
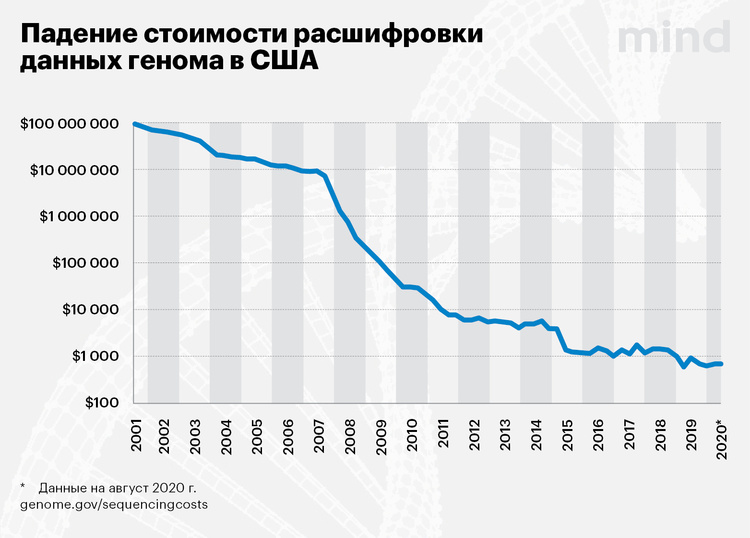
Но это – в мире. В Украине цена исследования генома пока необычайно высокая – почти 100 000 грн, или $4000. А с дополнительными исследованиями, например, выявлением синдрома микроделеции и микродупликации, и вовсе более 200 000 грн. По ценовым меркам США мы застряли где-то в 2014 году.
Дело, разумеется, не только в деньгах. Кроме самих исследований, применение методов персонализированной медицины предполагает терапевтическое вмешательство – то есть диагноз и эффективное для конкретного пациента лекарство, персонализированное или уже существующее на рынке.
И вот тут начинаются настоящие сложности. Лекарство нужно или купить за рубежом и сертифицировать в Украине, или изготовить, к чему наша фармакология пока не готова, поскольку специализируется на массовом производстве не самых новых, но зато недорогих дженериков. Новых препаратов, на которые западные фармкомпании уже потратили сотни тысяч долларов, в Национальном перечне лекарств Украины просто не существует. А врач предпочтет не назначать несертифицированный препарат, применение которого, к тому же противоречит пусть и малоэффективному, но утвержденному протоколу лечения.
Соответственно Украина сможет получить преимущества персонализированных диагностики и лечения тогда, когда будет готова не только оплатить их, но и имплементировать на уровне действия системы национального здравоохранения и ее законодательного оформления.
Тем временем мировой рынок точной медицины уже довольно велик – $66,85 млрд в 2020 году, по данным ReportLinker. И он продолжает расти: из-за различных определений и методов объем рынка к 2025 году оценивается от $100 млрд до более $2 трлн. При этом большинство исследовательских фирм считают, что совокупный среднегодовой темп роста за этот период составит 10–11%.
Естественный рост рынка, как практическое применения научных разработок в целом, требуют законодательного регулирования не только в Украине. Первопроходцем в этом, как и в научных исследованиях, являются США. Еще до COVID-19 там начали с разработки законопроектов ( например, Закона о расширении доступа к точной медицине), которые позволят Штатам использовать налоговые льготы, чтобы покрыть клинические услуги по секвенированию полного генома для детей, заболевания которых могут иметь генетическую природу.
На практике это означает, что через пока неопределенный, но сравнительно небольшой промежуток времени человечество сможет получить систему диагностики и лечения совершенно другого уровня, ориентированную на человека и доступную для всех на законодательном уровне.
Если вы дочитали этот материал до конца, мы надеемся, это значит, что он был полезным для вас.
Мы работаем над тем, чтобы наша журналистская и аналитическая работа была качественной, и стремимся выполнять ее максимально компетентно. Это требует финансовой независимости.
Станьте подписчиком Mind всего за 196 грн в месяц и поддержите развитие независимой деловой журналистики!
Вы можете отменить подписку в любой момент в собственном кабинете LIQPAY, или написав нам по адресу: [email protected].





