Персоналізована медицина: як лікують те, що ще вчора було вироком
Які шанси має Україна досягти «стійких» здоров'я і добробуту для всіх своїх громадян
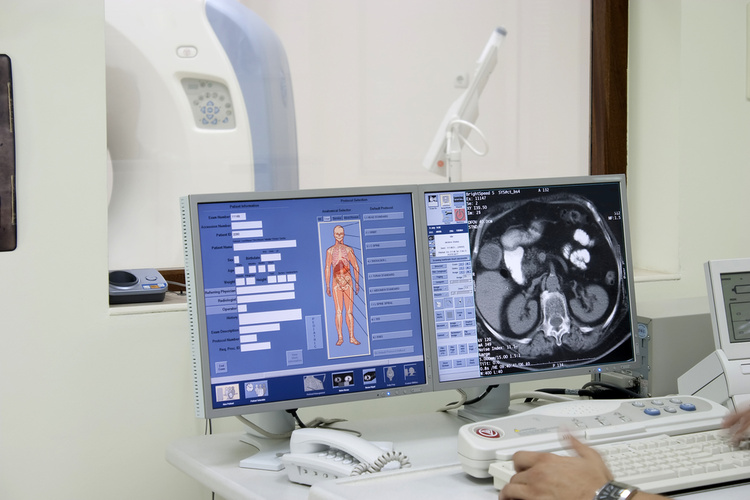
Цілком здорового п'ятитижневого малюка терміново госпіталізували до дитячої лікарні Реді-Сан-Дієго, Каліфорнія після того, як він протягом двох годин заходився від плачу, що, здавалося, не мав видимих причин. Комп'ютерна томографія голови показала значні множинні відхилення щільності тканин.
Батьки впали в розпач. Десять років тому в їхньої першої дитини за кілька місяців після народження почалися подібні неврологічні прояви, які швидко прогресували до епілептичної енцефалопатії. Одинадцятимісячний малюк помер без діагнозу.
На щастя, 10 років у науці – значний строк. Проблему, яка здавалася тоді нерозв'язною і згодом стала причиною хвороби у 2021 році, було вирішено менш, ніж за добу. Дві години пішло на необхідні процедури включно зі збором аналізів, 11 годин витратили на секвестр генома, і через 16,5 години було поставлено діагноз – синдром дисфункції метаболізму тіаміну 2 (THMD2).
Парадокс у тому, що при такій складній діагностиці та можливих фатальних наслідках, лікування цієї хвороби виявилося елементарним – вітаміни B1 і В7 (біотин). Вже за шість годин після першого прийому симптоми захворювання зникли.
Слід розуміти, що поставити такий діагноз без персоналізованої генної медицини практично неможливо. Синдром THMD2 – вкрай рідкісне генетичне захворювання, яке, за оцінкою вчених, зустрічається в одного немовляти з мільйона. Більшість лікарів, якщо і знають про нього, все одно не здатні поставити діагноз на основі традиційного фізикального обстеження. І навіть загальний діагноз допоможе мало: дитяча енцефалопатія – захворювання, що вражає або повністю знищує клітини мозку, пов'язане приблизно з 1500 генетичними захворюваннями, більшість із яких клінічно не відрізняються й вимагають унікального лікування.

ООН, Обама, Гіппократ і Цукерберг
Третя мета сталого розвитку ООН – «Забезпечення здорового способу життя та сприяння добробуту для людей у будь-якому віці», від немовлят до людей похилого віку. Для досягнення мети необхідні «додаткові зусилля задля повної ліквідації широкого спектру хвороб і вирішення багатьох постійних і нових проблем охорони здоров'я».
Але донедавна значна кількість захворювань, як-от синдром Альцгеймера, не піддавалися ефективному лікуванню традиційними способами. Як і рідкісні генетичні захворювання, про які у XX столітті тільки почали здогадуватися, а в XXI – намагатися лікувати. Всі вони, включно з раком, СНІДом і нейродегенеративними захворюваннями, завдають величезної шкоди окремим людям, сім'ям і суспільству загалом, руйнуючи спроби людства досягти сталого розвитку.
То звідки ж візьмуться ці самі додаткові зусилля, яких вимагає ООН? Віднедавна США та ЄС бачать порятунок у персоналізованій медицині, яку ще називають точною або прецизійною (Precision Medicine Initiative). Це «новий підхід до лікування і профілактики захворювань, що враховує індивідуальну мінливість генів, довкілля та способу життя кожної окремо взятої людини».
Першим із глобальних політиків її оцінив Барак Обама. У своєму зверненні ще в січні 2015 року тодішній президент США оголосив, що запускає Ініціативу точної (персоналізованої) медицини. Обама назвав її сміливим дослідним зусиллям, революцією в тому, як ми покращуємо здоров'я і лікуємо хвороби.
У майбутнє такого підходу повірив і бізнес: Білл Гейтс вклав $50 млн у дослідження хвороби Альцгеймера на основі точних даних, а Цукерберг і його дружина, доктор Прісцилла Чан, пожертвували $10 млн на розвиток Університету Північної Кароліни UCSF Spoke, який називають «мозком» точної медицини.
Сьогодні вже ВООЗ називає розвиток системи охорони здоров'я, орієнтованої на кожного конкретного індивіда, одним із пріоритетів своєї європейської політики.
Разом із тим у самій ідеї світових лідерів немає нічого нового.
Ще Гіппократ наголошував на важливості лікування кожного пацієнта як окремої людини. «Не всі пацієнти можуть пити ті самі (ліки)», – писав він. А фраза про те, що «лікар повинен лікувати хворого, а не хворобу» стала крилатою ще в XІX столітті.
Щоправда, Гіппократ, який працював у V столітті до нашої ери, міг персоналізувати методи лікування тільки зважаючи на спостереження за особливостями пацієнта. З розвитком науки процес вийшов на новий рівень. Персоналізована медицина обіцяє індивідуальні методи лікування, засновані на вивченні того, що дійсно робить нас унікальними – нашої ДНК.
Якщо зовсім коротко, то процедура виглядає так: людина здає аналіз ДНК, дані його генома розшифровуються, лікар оцінює результати, видає рекомендації та виписує ліки, які максимально підходять конкретній людині. При цьому враховуються тонкі фактори і взаємодії, які практично неможливо оцінити без вивчення генома й побічних наслідків частин самого препарату.
Головна перевага технології – можливості. Головний недолік – вартість.
Що може персоналізована медицина
Сьогодні медики виділяють кілька основних напрямів персоналізованої медицини.
Перший, профілактичний – переддіагностіка потенційних захворювань на основі розкриття генетичної інформації кожної людини, виявлення «слабких місць» організму й попередження потенційних ризиків, які можуть проявитися протягом життя під впливом різноманітних зовнішніх факторів. Йдеться не лише про рідкісні захворювання або рак, а й про сепсис, серцево-судинні захворювання і навіть депресію. Такий підхід вже доступний у розвинених країнах і дозволяє попередити практично всі захворювання, пов'язані з генетикою та впливом на організм навколишнього середовища і способу життя.
Другий – вичленення типових (частих або рідкісних) мутацій генів (біомаркерів) і створення методологій та препаратів для груп людей, у геномі яких ця мутація присутня. У такій групі може бути від декількох до сотень тисяч людей, що дозволяє знизити вартість лікування, залишаючи його фактично індивідуальним.
Третій – повністю індивідуальне лікування. Цей підхід зазвичай найдорожчий, оскільки включає два найскладніших процеси: втручання на рівні генів для виправлення «помилок» у коді ДНК і складання персональних рецептів ліків для конкретного пацієнта.
Як це виглядає на практиці: генетичний напрям
На сьогодні найбільший сегмент застосування персоналізованої медицини – онкологія. Вона займає 34,75% ринку. До 2021 року вже було виявлено понад 100 видів злоякісних новоутворень, при цьому для кожної пухлини характерні різні біохімічні та генетичні особливості. Саме тому поки нікому не вдалося розробити універсальні ефективні методи лікування. За даними Bayer, «у сфері протипухлинної терапії показники частоти відповіді на деякі методи лікування сягають лише 20%, або, інакше кажучи, відповідь на терапію є тільки в кожного п'ятого пацієнта».
Це вагомий аргумент на користь розробки персоналізованих підходів і необхідності створювати препарати, що прицільно впливають на конкретні типи пухлин. Чим точніше лікарський засіб визначає спектр свого впливу на злоякісні клітини, тим більш вираженим буде його ефект щодо конкретного захворювання і тим нижчим буде ризик розвитку побічних ефектів.
З другого боку, вчені працюють над розробкою специфічних методів аналізу, які навіть перед початком лікування дозволять визначити, чи справить препарат виражений терапевтичний ефект на конкретну форму злоякісного новоутворення, що є у пацієнта.
У 2020 році у світі зафіксовано приблизно 19,3 млн нових випадків онкозахворювань і майже 10 млн випадків смерті від раку. Цифри точної кількості пацієнтів, які були врятовані завдяки інноваціям у медицині просто не існує. При цьому FDA вже схвалило десятки ліків, що цілеспрямовано борються з конкретною мутацією ракових клітин. До таких, наприклад, належать іматиніб (Глівек) – ліки, використовувані при хронічному мієлолейкозі, або ліки від раку грудей трастузумаб (Герцептин).

Як це виглядає на практиці: вирощування органоїдів
Негенетичний напрям точної медицини, що дозволяє отримати точний тест впливу навіть неперевірених ще ліків на організм людини, полягає у використанні «органоїдів». Цю технологію також називають organ-on-a-chip і полягає вона в штучному вирощуванні клітин (і цілих тканин) тіла конкретної людини для перевірки препаратів.
Перші органоїди складалися з живих клітин, вбудованих у тривимірну матрицю гідрогелю та з'єднаних із потоком живильної рідини каналами, що за розмірами вимірювалися в сотнях мікрометрів.
Сучасні пристрої складаються з декількох типів клітин і точно імітують деякі внутрішні мікроструктури та функції органів. Людина, що здала для такого експерименту кілька клітин, може віддалено отримати копію одного або декількох своїх органів, на яких і випробовуються різні методи лікування. У результаті для пацієнта виготовляють препарат, що максимально підходить саме його організму.
Майбутнє вже настало.
Якщо раніше ці системи створювалися-вирощувалися вручну, то сьогодні їх вже друкують на 3D-принтерах і застосовують у створенні біомоделей для досліджень у сфері онкології. Тобто фактично медики впритул підійшли до дослідів на людині – але без участі самої людини.
Використовуючи тривимірний біодрук, фотолітографію та інші методи, дослідницькі групи створили різні органоїди, що відтворюють певні функції своїх аналогів в організмі людини: кишківник, який поглинає поживні речовини, ракові утворення, що вражають інші тканини, серцевий м'яз, який скорочується, і навіть легені, що «вдихають» сигаретний дим.

Але справжня цінність технології стає очевидною, коли ви поєднуєте кілька органоїдів. Наприклад, у Корнельському університеті (США) побудували мікрофізіологічну систему, яка містить три типи органоїдів: печінку, кістковий мозок і пухлину товстої кишки – на одному чіпі із закритим кровообігом. Дослідники використовували його для вивчення метаболізму ліків, побудованого на базі протиракового нетоксичного препарату Тегафур, який вже давно застосовується в медицині. Якщо вводити ліки перорально, їхній ефект обмежений, але якщо безпосередньо в печінку – він, як виявилося, метаболізується ферментом і стає ефективним проти раку. Оскільки препарат не новий, змінюється лише спосіб його застосування, а це може істотно знизити вартість лікування і зробити його більш доступним.
Ціна питання: у світі й в Україні
Одна з найбільших претензій до персоналізованої медицини – її вартість, що автоматично означає її недоступність для більшості людей. Все-таки в глобальних планах ООН нарівні з якісною медициною акцент робиться і на її доступності.
Практика показує, що витрати з часом скорочуються, а ефективність зростає за експонентою. Перша розшифровка послідовності генома людини 30 років тому коштувала $3 млрд. У 2010-х компанії вже пропонували індивідуальне секвенування генома за кілька тисяч доларів, сьогодні ж повна розшифровка в США коштує близько тисячі доларів, а часткова – максимум 100.
При цьому, якщо пацієнт у США погоджується надати деяку інформацію про своє здоров'я, що буде використана в подальшому науковому аналізі, секвенування буде для нього повністю безкоштовним.
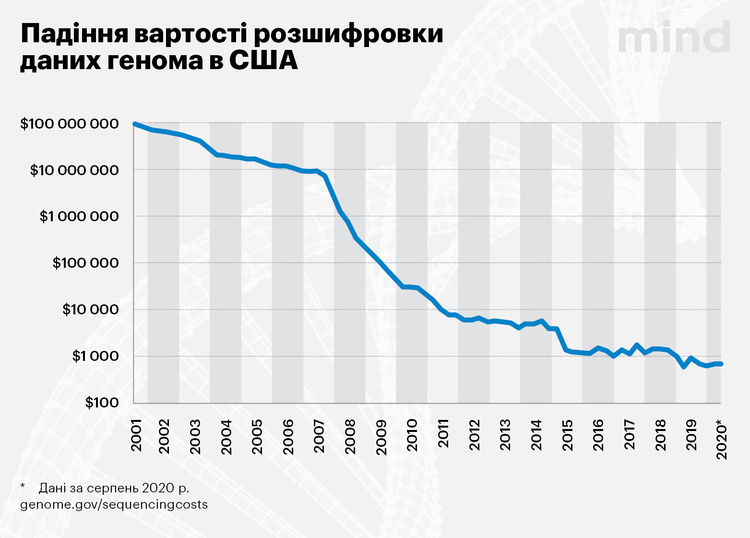
Але це – у світі. В Україні вартість дослідження генома поки надзвичайно висока – майже 100 000 грн, або $4000 А з додатковими дослідженнями, наприклад виявленням синдрому мікроделеції та мікродуплікаціі – понад 200 000 грн. За ціновими вимірами США ми застрягли десь у 2014 році.
Йдеться, звісно, не лише про гроші. Окрім самих досліджень, застосування методів персоналізованої медицини передбачає терапевтичне втручання – тобто діагноз і ефективні для конкретного пацієнта ліки, персоналізовані або вже наявні на ринку.
І тут починаються справжні труднощі. Ліки потрібно або купити за кордоном і сертифікувати в Україні, або виготовити, до чого наша фармакологія поки не готова, оскільки спеціалізується на масовому виробництві не найновіших, проте недорогих дженериків. Нових препаратів, на які західні фармкомпанії вже витратили сотні тисяч доларів, у Національному переліку ліків України просто не існує. А лікар вважатиме за краще не призначати несертифікований препарат, застосування якого до того ж суперечить нехай і малоефективному, зате затвердженому протоколу лікування.
Відповідно Україна зможе отримати переваги персоналізованих діагностики та лікування тоді, коли буде готова не тільки платити за них, а й імплементувати на рівні дії системи національної охорони здоров'я та її законодавчого оформлення.
Тим часом світовий ринок точної медицини вже немалий – $66,85 млрд в 2020 році, за даними ReportLinker. І він продовжує зростати: через різні визначення і методи його обсяг на 2025 рік оцінюють від $100 млрд до понад $2 трлн. При цьому більшість дослідницьких фірм вважають, що сукупний середньорічний темп росту за цей період становитиме 10–11%.
Природне зростання ринку, як і практичне застосування наукових розробок загалом, вимагають законодавчого регулювання не тільки в Україні. Першопрохідцем у цьому, як і в наукових дослідженнях, є США. Ще до COVID-19 там почали з розробки законопроєктів (наприклад, Закону про розширення доступу до точної медицині), які дозволять Штатам використовувати податкові пільги, щоб покрити клінічні послуги із секвенування повного генома для дітей, чиї захворювання можуть мати генетичну природу.
На практиці це означає, що за поки невизначений, але порівняно невеликий проміжок часу людство зможе отримати систему діагностики та лікування зовсім іншого рівня, орієнтовану на людину й доступну для всіх на законодавчому рівні.
Якщо ви дочитали цей матеріал до кінця, ми сподіваємось, що це значить, що він був корисним для вас.
Ми працюємо над тим, аби наша журналістська та аналітична робота була якісною, і прагнемо виконувати її максимально компетентно. Це вимагає і фінансової незалежності.
Станьте підписником Mind всього за 196 грн на місяць та підтримайте розвиток незалежної ділової журналістики!
Ви можете скасувати підписку у будь-який момент у власному кабінеті LIQPAY, або написавши нам на адресу: [email protected].

















