Вакцини-фронтранери: топ-5 імовірних рятівників світу від пандемії COVID-19
Mind пропонує ознайомитися з п'ятьма основними типами вакцин від коронавірусу SARS-CoV-2 і найпередовішими з препаратів
Для стримування пандемії COVID-19, яка тероризує планету, по всьому світу форсованими темпами ведеться розробка 180 вакцин різноманітних видів. Згідно з трекером covid-19vaccinetracker.org, найпросунутіші препарати, ефективність яких була протестована на людях і підкріплена гігантськими урядовими грантами, належать до п'яти типів – вони створені на основі деактивованого коронавірусу, його поверхневих білків, аденовірусного вектора, а також синтезованих ДНК і РНК.
Mind пропонує дізнатися про найперспективніші вакцини з цих п'яти категорій.
CoronaVac – неактивний коронавірус від Sinovac (Китай)
Завершується фаза І тестування на 144 волонтерах і ІІ – на 600 добровольцях.
Деактивація – це давній і перевірений спосіб виготовлення вакцин. Віруси вирощують у лабораторних умовах, а потім зменшують їхню хвороботворність – здатність інфікувати людину й завдати їй шкоди. Перевага деактивованих вірусів у тому, що таку вакцину можна зробити безпечною для людей з ослабленою імунною системою.
Китайці першими кинулися розробляти засіб від COVID-19 традиційним шляхом і, випередивши зарубіжних дослідників на старті, просунулися в цьому найдалі. Наразі другу стадію клінічних випробувань проходять чотири китайські вакцини, створені на основі очищеного й деактивованого коронавірусу. CoronaVac – найбільш розрекламована і, ймовірно, найперспективніша з них.
Навесні 2020 року голова пекінської біофармацевтичної компанії Sinovac Biotech Інь Вейдун оголосив, що під час доклінічних випробувань на мишах, щурах і макаках препарат CoronaVac забезпечив тваринам безпечний й повний захист проти штамів SARS-CoV-2.
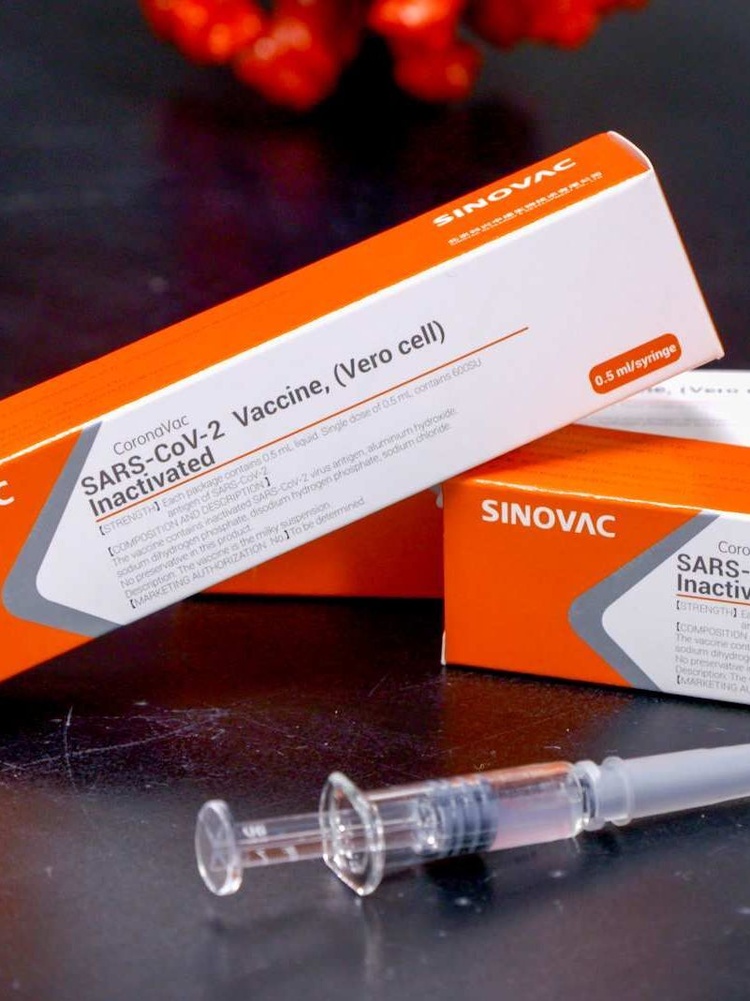
У травні на 144 здорових людях була запущена перша фаза клінічного тестування, яка має показати безпеку, переносимість і попередню імуногенність цієї вакцини. Не чекаючи результатів перших випробувань, Sinovac запустила і другу фазу на 600 добровольцях для визначення ефективності та дозування CoronaVac.
Третя фаза випробувань китайської вакцини пройде в Бразилії – другій найбільш постраждалій від пандемії країні після США.
Днями влада бразильського штату Сан-Паулу повідомила, що з 20 липня почнуть тестування Sinovac на 9000 добровольцях, і в разі успіху допоможуть китайцям налагодити «великомасштабне виробництво» цього препарату.
AZD1222 – вакцина на основі аденовірусного вектора від AstraZeneca (Великобританія)
Розпочато фазу ІІІ тестування на понад 5000 дорослих добровольцях у Великобританії, США, Бразилії та ПАР.
Векторами в мікробіології називають інструменти для доставлення генетичного матеріалу в клітини організму. Зазвичай вектори створюють на основі нешкідливих ослаблених вірусів.
Векторна вакцина AZD1222 була розроблена в Інституті Дженнера при Оксфордському університеті. Її основою послужив ChAdOx1 – безпечний для людини ослаблений вірус застуди (аденовірус), що викликає інфекцію в шимпанзе, але позбавлений здатності до реплікації (відтворення) в організмі людини. Цей вектор зчеплений зі специфічним генетичним матеріалом – тими S-білками, які зазвичай стирчать із поверхні SARS-CoV-2 і утворюють йому «корону». Опиняючись в організмі після вакцинації, ці S-білки налаштовують імунну систему людини атакувати коронавірус в разі зараження.

Британсько-шведський фармацевтичний гігант AstraZeneca отримав величезні гранти на виробництво вакцини AZD1222, зокрема $1,2 млрд від уряду США і $80 млн від влади Британії. Керівники AstraZeneca пообіцяли з надшвидкістю до осені 2020 року провести фінальну третю фазу випробувань на людях вакцини AZD1222 та розпочати масове виробництво цього препарату. За даними агентства Reuters, вартість вакцини AZD1222 в країнах Європи становитиме близько 2,5 євро за дозу.
NVX-CoV2373 – субодинична білкова вакцина від Novavax (США)
Фази I й II були запущені на 130 здорових людях у травні в Австралії.
Не обов'язково штурмувати імунну систему цільними вірусами, піддаючи її зайвому стресу. Можна виділити фрагмент вірусу й використовувати тільки його для виклику потрібної імунної відповіді та стимулювання імунітету. Такі вакцини називаються субодиничними і застосовуються для захисту людей від гепатиту Б та оперізувального лишаю.
Американська біотехнологічна компанія Novavax за допомогою своєї запатентованої технології наночастинок навчилася створювати в чистому вигляді і стабільному стані шипи тієї самої «корони» – поверхневі білки вірусу SARS-CoV-2. За твердженням Novavax, її вакцина NVX-CoV2373 складається з цих білків, сформованих у термостійкі 27,2-нанометрові частинки. Також препарат містить ад'ювант Matrix-M для посилення імунних реакцій і стимуляції високих рівнів нейтралізуючих антитіл.
Поверхневі білки вірусу
Навесні 2020 року Novavax підтвердила в дослідах на мавпах, що NVX-CoV2373 здатний надійно захистити організм від коронавірусної інфекції, і 25 травня був оголошений запуск перших двох фаз тестування цього препарату на людях. Незабаром компанія переконала в ефективності своєї вакцини уряд США, і 7 липня отримала від нього грант у розмірі $1,6 млрд, який є найбільшим.
Раніше значний грант у розмірі $388 млн на розробку NVX-CoV2373 для Novavax виділив недержавний фонд «Міжнародна коаліція із забезпечення готовності до епідемій» (CEPI). Це посприяло астрономічному зльоту акцій Novavax, що підскочили в ціні у 22 рази – з $4,5 у січні до $100 у липні.
INO-4800 – ДНК-вакцина від Inovio (США)
Прогрес: проведена фаза I клінічних випробувань на 40 добровольцях.
ДНК-вакцини називають біологічними препаратами наступного покоління, бо їх можна швидко й легко виготовляти, але жоден з них досі не схвалений регуляторами для застосування на людях. В основі цих вакцин – синтезована молекула ДНК, яка після введення в організм проникає в ядро клітини й перетворює рибосоми цієї клітини на фабрики з виробництва чужорідних білків, що готує імунну систему до відбиття атаки з боку можливого зараження.
У травні 2020 року американська компанія Inovio повідомила, що доклінічні випробування підтвердили здатність її ДНК-вакцини INO-4800 стимулювати вироблення нейтралізуючих антитіл і Т-клітинного імунітету проти коронавірусу SARS-CoV-2. До кінця червня їй вдалося переконати в цьому Міністерство оборони США, що надало компанії $71 млн.
Днями Inovio розповіла, що 94% з 40 учасників клінічних випробувань її вакцини «продемонстрували імунну відповідь на шостому тижні після двох доз INO-4800» і що ці дозування «були визнані безпечними й добре переносяться без будь-яких серйозних побічних ефектів».
Компанія ще не розпочала другу фазу клінічних досліджень, і зараз, у липні 2020 року, виглядає такою, що відстає від фаворитів у перегонах виробників вакцин. Але навіть якщо вона приведе INO-4800 до фінішу на багато місяців пізніше препаратів-конкурентів, все одно вона після отримання від регуляторів допуску на ринки зможе зайняти на них хороші позиції за рахунок швидкості й дешевизни виробництва ДНК-вакцини.
mRNA-1273 – РНК-вакцина від Moderna (США)
Прогрес: проведена фаза I на восьми досліджуваних та розпочато фазу II на 600 добровольцях у США.
РНК-вакцини аналогічні ДНК-вакцинам, але їх створюють на основі синтезованої макромолекули РНК, яка також впливає на виробництво білків у живій клітині. Ці експериментальні препарати теж можна швидко й легко виробляти, але на ринку досі немає жодного з них.
Американська компанія Moderna Therapeutics, що спеціалізується на синтезі молекул РНК, чекала на низькому старті появи інформації для створення РНК-вакцини від COVID-19. Після того як китайські вчені 11 січня опублікували в мережі генетичну послідовність SARS-CoV-2, фахівці Moderna відклали всі свої проекти й занурилися в роботу над цим вірусом. З його генома вони виділили фрагмент, повторювані послідовності якого сформували в нитки РНК та упакували в молекули, звані ліпідами. Так була створена вакцина mRNA-1273, яка вже в лютому була показана владі США, що виділила на її розробку $483-мільйонний грант і дозволила протестувати вакцину на людях. У травні Moderna оголосила про успішне проведення першої фази клінічних випробувань mRNA-1273. За її твердженням, у всіх восьми досліджуваних, кожному з яких вкололи в плече маленьку дозу вакцини, протягом 28 днів виробилися антитіла до COVID-19.
У недавньому пресрелізі Moderna повідомила про виготовлення необхідної кількості вакцини mRNA-1273 для проведення на 30 000 добровольцях фінальної ІІІ фази її тестування, яке має намір почати вже наприкінці цього місяця. У разі успіху випробувань компанія зможе налагодити випуск до мільярда доз своєї РНК-вакцини на рік.
Якщо ви дочитали цей матеріал до кінця, ми сподіваємось, що це значить, що він був корисним для вас.
Ми працюємо над тим, аби наша журналістська та аналітична робота була якісною, і прагнемо виконувати її максимально компетентно. Це вимагає і фінансової незалежності.
Станьте підписником Mind всього за 196 грн на місяць та підтримайте розвиток незалежної ділової журналістики!
Ви можете скасувати підписку у будь-який момент у власному кабінеті LIQPAY, або написавши нам на адресу: [email protected].













